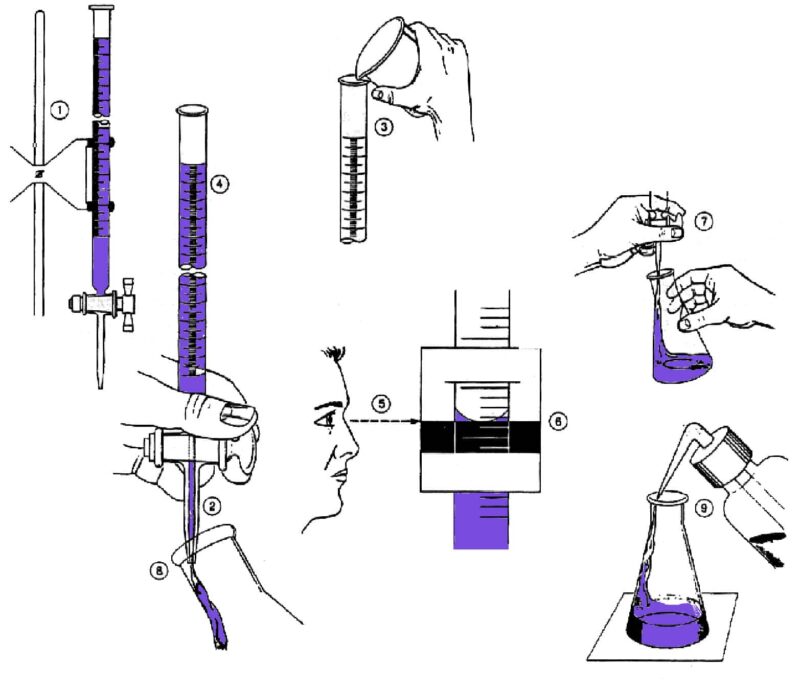
Titrasi Asam Basa – Titrasi adalah metode yang digunakan untuk menganalisis secara kuantitatif dalam menentukan konsentrasi atau kadar pada suatu larutan, dengan menetesi larutan yang akan dicari kadarnya dengan larutan lain yang sudah diketahui kadarnya, yaitu larutan standar dan volumenya telah terukur, secara bertahap.
Berdasarkan dari jenis reaksi yang berlangsung, titrasi digolongkan menjadi titrasi asam basa, titrasi redoks dan titrasi pengendapan. Nah, kita akan membahas khusus titrasi asam basa saja kali ini.
Pernahkah kamu melihat botol cuka? Dari kemasan botolnya pasti tertulis kadar asam dari cuka tersebut, misalnya 25% asam cuka, lantas bagaimana cara memastikan jika hal tersebut benar? Metode titrasi asam basa adalah cara yang tepat.
Pengertian Titrasi Asam Basa
Titrasi asam basa merupakan penentuan kadar pada larutan basa menggunakan larutan asam yang telah diketahui kadarnya, berlaku juga sebaliknya, kadar larutan asam menggunakan larutan basa yang konsentrasinya telah diketahui dengan menggunakan dasar reaksi netralisasi. Titrasi wajib dilaksanakan sampai mencapai titik ekivalen, yakni waktu dimana asam juga basa tepat selesai bereaksi dengan stoikiometri.
Pada umumnya, titik ekivalen ditandai dengan warna indikator yang berubah warna. Keadaan atau waktu dimana titrasi harus distop tepat ketika indikator berubah warna, hal tersebut disebut dengan titik akhit titrasi. Sehingga, untuk mendapatkan hasil titrasi yang tepat, selisih titik akhir dan titik ekivalen diusahakan sekecil mungkin.
Hal ini bisa diupayangan dengan pemilihan indikator yang tepat ketika titrasi asam basa, yaitu indikator yang dapat mengalami perubahan warna pada sekitar titik ekivalen.
Perubahan pH pada Titrasi Asam Basa
Ketika larutan basa diberi tetesan larutan asam, maka akan menyebabkan pH larutan turun. Sebaliknya, apabila larutan asam diberi tetesan larutan basa, maka menyebabkan pH larutan naik. Apabila pH larutan basa dan larutan asam diplotkan sebagai fungsi volume larutan asam maupun basa yang diteteskan, maka akan didapatkan suatu bentuk grafik yang dinamakan kurva titrasi.
Kurva titrasi menyatakan perubahan pH pada larutan selama proses titrasi antara larutan basa dan asam, ataupun sebaliknya. Bentuk kurva titrasi mempunyai karakter tersendiri tergantung dengan konsentrasi serta kekuatan dari basa dan asam yang bereaksi.
Titrasi Asam Kuat dan Basa Kuat
Untuk contohnya, larutan HCl 0,1 M sebanyaj 40 mL ditetesi sedikit demi sedikit dengan larutan NaOH 0,1 M. Di bawah ini kurva titrasi asam basa yang menunjukkan perubahan pH selama titrasi berlangsung. Yakni:
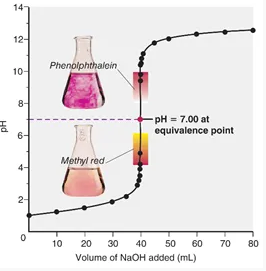
Berdasarkan kurva titrasi asam kuat basa kuat seperti di atas, maka dapat kita simpulkan bahwa:
- Awalnya pH larutan naik pelan-pelan. Sedikit demi sedikit.
- Perubahan pH secara drastis terjadi pada sekitar titik ekivalen.
- pH titik ekivalen yakni 7 (netral)
- Indikator yang bisa digunakan yaitu bromtimol biru, fenolftalein atau metil merah. Akan tetapi yang lebih umum digunakan adalah indikator fenolftalein, dikarenakan perubahan warna pada fenolftalein lebih mudah untuk diamati.
Titrasi Asam Lemah dan Basa Kuat
Contohnya, larutan CH3COOH 0,1 M sebanyak 40 mL ditetesi menggunakan larutan NaOH 0,1 M dengan cara sedikit demi sedikit. Di bawah ini kurva titrasi dengan warna biru yang menyatakan perubahan pH selama proses titrasi dibandingkan kurva titrasi HCl dan NaOH yang memiliki warna merah.
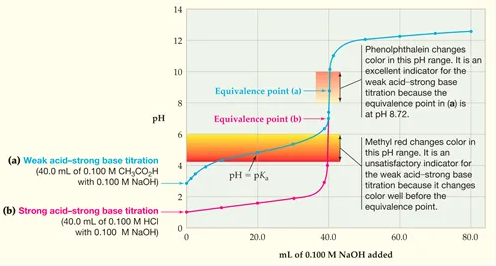
Berdasarkan kurva titrasi asam lemah basa kuat seperti di atas, maka bisa disimpulkan bahwa :
- Titik ekivalen berada pada pH diatas 7, yakni kisaran 8 hingga 9.
- Perubahan pH di titik ekivalen lebih kecil, yakni hanya berkisar 3 satuan saja, yaitu antara pH7 hingga pH 10.
- Indikator yang bisa digunakan: fenolftalein, untuk metil merah tidak bisa digunakan karena perubahan warna pada indikator tersebut berlangsung jauh sebelum tercapainya tiitk ekivalen.
Titrasi Basa Lemah dengan Asam Kuat
Contohnya larutan NH3 0,1 M sebanyak 40 mL ditetesi sedikit demi sedikit dengan larutan HCl 0,1 M. Di bawah ini merupakan tampilan kurva titrasi basa lemah dengan asam kuat yang menyatakan adanya perubahan pH ketika titrasi tersebut berlangsung.
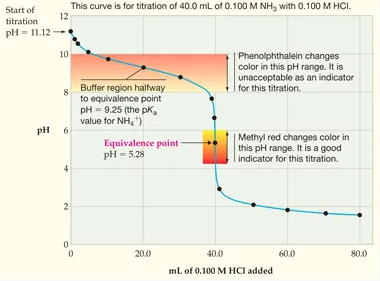
Berdasarkan kurva titrasi basa lemah dengan asam kuat seperti di atas, maka dapat diambil kesimpulan seperti berikut ini:
- Titik ekivalen ada pada pH di bawah 7, yaitu kisaran 5 hingga 6.
- Perubahan pH secara drastis terjadi di sekitar titik ekivalen sedikit, yakni hanya kisaran 3 satuan antar pH 7 hingga pH 4.
- Indikator yang dapat digunakan yakni metil merah. Sementara fenolftalein tidak bisa digunakan disebabkan perubahan warna terjadi jauh sebelum tercapainya titik ekivalen.
Perhitungan Kadar Larutan Asam atau Basa pada Titrasi Asam Basa
Langkah-langkah yang dilakukan untuk menghitung konsentrasi atau kadar larutan basa atau asam pada titrasi asam basa yaitu:
- Menulis persamaan reaksi netralisasi yang berlangsung, contohnya reaksi antara larutan asam A dan larutan basa B. maka seperti di bawah ini:
aA + bB -> cC + dD + …
- Menampilkan perbandingan antara jumlah mol asam A serta basa B yang sedang bereaksi supaya tepat habis reaksi.
- nA
- : nB = a : b
- Menghitung konsentrasi atau kadar larutan basa atau asam berdasarkan persamaan perbandingan di atas.
![]() Dimana
Dimana
NA : nB merupakan jumlah mol asam A dan juga basa B.
a dan b merupakan koefisien reaksi dari asam A dan juga basa B.
MA, MB merupakan molaritas dari asam A dan juga basa B.
VA, VB merupakan volum dari larutan asam A serta basa B.
Apabila valensi asam A serta basa B yang bereaksi telah diketahui, maka konsentrasi atau kadar larutan asam maupun basa juga bisa dicari menggunakan rumus:
MA x VA x valensiaA = MB x VB x valensiaB
Jenis Titrasi Asam Basa
Berdasarkan jenis dari zat sample serta larutan standarnya, maka titrasi asam basa dibedakan menjadi dua jenis, yaitu:
1. Titrasi Alkalimetri
Alkalimetri adalah jenis titrasi dimana larutan standarnya menggunakan larutan basa. Titrasi alkalimetri merupakan titrasi yang sangat sering digunakan. Jenis basa yang digunakan pada titrasi jenis ini adalah larutan basa kuat.
2. Titrasi Asidimetri
Titrasi asidimetri adalah jenis titrasi yang menggunakan larutan asam sebagai larutan standarnya. Sementara jenis asam yang digunakan adalah asam kuat sehingga akan mendapatkan pH netral ketika menggunakan sample basa kuat dan reaksi penetralan akan berjlangsung sempurna. Akan tetapi, akan menghasilkan pH asam jika sampel yang dipilih adalah basa lemah dan menyebabkan penetralan cenderung ke asam.
Titrasi asam basa merupakan prosedur dalam kimia guna menentukan konsentrasi suatu zat dengan zat yang telah dikeathui konsentrasinya, dalam hal ini adalah mentitrasi asam dengan basa maupun sebaliknya. Larutan asam yang diteteskan ke larutan basa menyebabkan pH larutan turun, sementara larutan basa yang diteteskan ke larutan asam menyebabkan pH larutan menjadi naik.
Titrasi asam basa dengan larutan standar basa kuat disebut dengan titrasi alkalimetri, sedangkan titrasi asam basa yang menggunakan larutan standar berupa asam kuat disebut dengan titrasi asidimetri.