Larutan penyangga (buffer) – Pasti kamu sering mendengar kata penyangga bukan? Sesuatu yang berfungsi untuk mempertahankan. Begitu juga dengan larutan penyangga atau yang bisa disebut juga dengan larutan buffer.
Dalam kesempatan kali ini, kita akan bahas tuntas mengenai pengertian larutan penyangga lengkap dengan komponen, PH, fungsi, hingga sifat-sifat dari larutan buffer.
Pengertian Larutan Penyangga (Buffer)

Larutan penyangga merupakan larutan yang bisa menjaga atau mempertahankan pH dari pencampuran basa, asam ataupun pengenceran oleh air. pH larutan penyangga akan tetap konstan atau tidak berubah meskipun telah ditambahkan oleh sejumlah basa, asam ataupun air.
Selain itu, larutan buffer juga dapat menetralkan penambahan basa maupun asam dari luar. Hal tersebut disebabkan karena larutan buffer mengandung suatu zat terlarut yang memiliki sifat penyangga yang terdiri dari komponen basa dan asam. Komponen asam memiliki fungsi untuk menahan kenaikan pH, sementara komponen basa sebaliknya, yakni berfungsi untuk menahan penurunan pH.
Pada kehidupan sehari-hari, kita tidak dapat lepas dari yang namanya reaksi kimia, dalam hal ini adalah reaksi asam basa. Contohnya reaksi pada beberapa enzim pencernaan manusia. Enzim pepsin yang memiliki fungsi memecah protein lambung hanya bisa bekerja secara maksimal dalam kondisi asam atau jauh berbeda dengan pH optimal, sehingga enzim bisa menjadi rusak dan tidak aktif. Untuk mempertahankan pH enzim maka dibutuhkan larutan penyangga.
Komponen Larutan Penyangga
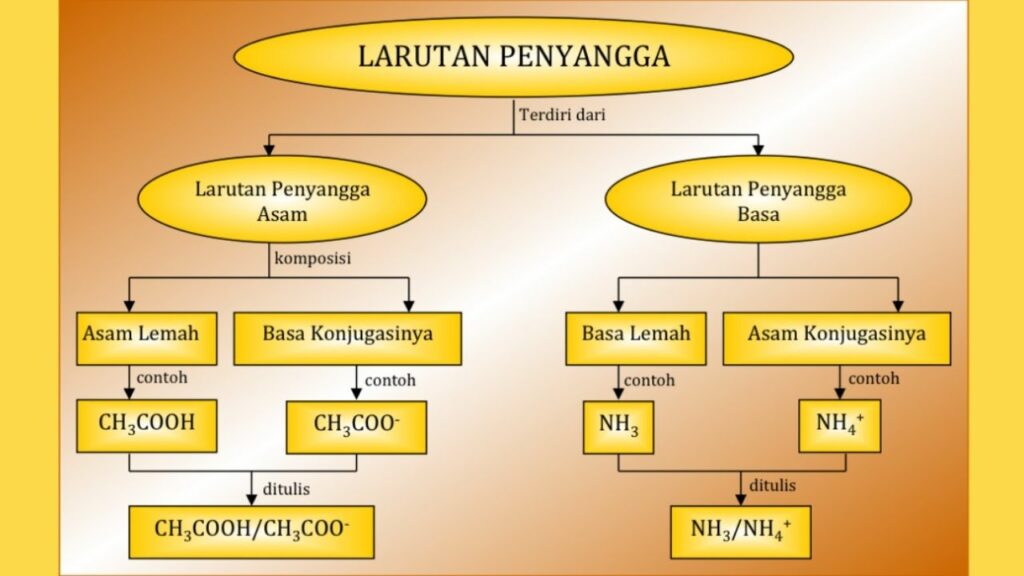
Seperti yang telah disinggung sebelumnya, larutan penyangga tersusun dari dua komponen, yakni larutan penyangga asam dan juga basa. Berikut penjelasan lengkapnya:
1. Larutan Penyangga Asam
Larutan buffer asam atau larutan penyangga asam bertugas mempertahankan pH dalam kondisi asam yakni pH<7. Larutan penyangga asam tersusun dari komponen basa konjugasi (A-) dan asam lemah (HA). Larutan penyangga basa bisa diperoleh melalui:
- Mencampurkan HA atau asam lemah dan garam basa konjugasinya LA dimana bisa terionisasi dan menghasilkan ion A-.
- Mencampurkan asam lemah dengan jumlah berlebih dan basa kuat yang dapat bereaksi, sehingga menghasilkan suatu garam basa konjugasi asam lemah tersebut.
Contohnya yaitu larutan buffer yang memiliki kandungan CH3COO- dan CH3COOH.
Pada larutan tersebut dapat ditemukan kesetimbangan kimia, yaitu:
CH3COOH(aq) ⇌ CH3COO-(aq)+ H+ (aq)
Ketika penambahan asam (H+), kesetimbangan akan bergerak atau bergeser ke sebelah kiri, kemudian reaksi akan mengarah kepada pembentukan CH3COOH. Sementara pada penambahan basa OH-, kesetimbangan bergeser menuju arah kanan dan terjadi pembentukan CH3COO- juga H+. Hal tersebut untuk mempertahankan konsentrasi ion H+ yang telah berkurang dikarenakan OH- tambahan bereaksi terhadap H+ yang kemudian menghasilkan H2O.
2. Larutan Penyangga Basa
Larutan penyangga basa bertugas untuk mempertahankan pH dalam suasana basa yakni pH > 7. Larutan penyangga basa tersusun atas komponen basa konjugasinya (BH+) dan basa lemah (B). Larutan tersebut bisa diperoleh dengan cara:
- Mencampurkan basa lemah dengan jumlah yang berlebih dan asam kuat sehingga terjadi suatu reaksi yang menghasilkan suatu garam asam konjugasi hasil dari basa lemah tersebut.
- Mencampurkan basa lemah atau B dan garam asam konjugasinya yakni BHX yang bisa terurai dan menghasilkan ion BH+.
Contohnya yaitu larutan buffer yang memiliki kandungan NH4+ dan NH3.
Dalam larutan tersebut dapat ditemukan kesetimbangan kimia, yaitu:
NH3(aq) + H2O(I) ⇌ NH4+(aq)+ OH-(aq)
Penambahan asam (H+), mengakibatkan kesetimbangan bergeser ke kanan, yaitu reaksi terbentuknya OH- dan NH4+. Hal tersebut guna mempertahankan konsentrasi pada ion OH- yang telah berkurang setelah ditambahkannya H+ dan bereaksi dengan OH- yang membentuk H2O.
Selanjutnya penambahan basa OH-, mengakibatkan kesetimbangan bergeser ke kiri, sehingga reaksi mengacu pembentukan air dan NH3. Atau bisa juga dikatakan basa yang telah ditambahkan kemudian dinetralisasi komponen asam konjugasi NH4+.
pH Larutan Penyangga

1. Larutan Buffer Asam
Pada larutan penyangga asam yang memiliki kandungan CH3COO- dan CH3COOH terdapat kesetimbangan seperti di bawah ini:
CH3COOH(aq) ⇌ CH3COO−(aq) + H+(aq)
CH3COOH(aq) ⇌ CH3COO−(aq) + H+(aq)
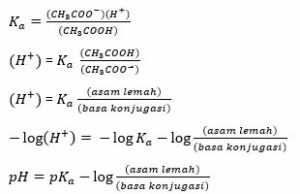
Sesudah dilakukan penyusunan ulang, pH larutan tersebut menjadi persamaan larutan buffer yang dikenal dengan sebutan persamaan Henderson – Hasselbalch, bunyi persamaan tersebut yaitu:
![]()
Apabila a = banyaknya mol asam lemah, g = banyaknya mol basa konjugasi serta v = volume larutan buffer, maka:

2. Larutan Buffer Basa
Dalam larutan penyangga basa yang memiliki kandungan NH4+ dan NH3, terdapat kesetimbangan sebagai beirkut:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)

Apabila b adalah banyaknya mol basa lemah, g adalah banyaknya mol asam konjugasi serta V adalah volume larutan buffer, maka:
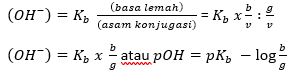
Fungsi Larutan Penyangga

Larutan buffer banyak dimanfaatkan dalam analisis kimia, mikrobiologi dan biokimia. Di samping itu, larutan penyangga juga banyak dimanfaat dalam dunia industri seperti pembuatan bir, elevtroplating atau penyepuhan, proses fotograsi, penyamakan kulit, sintesis obat-obatan, penanganan limbah dan sintesis zat warna.
Larutan penyangga juga dapat ditemukan dalam tubuh makhluk hidup, dimana keberadaannya memiliki peran yang sangat penting. Pada kondisi normal, pH darah manusia yakni 7,4 dan tidak boleh turun hingga kurang dari 7,0 maupun naik hingga melebihi 7,8, karena jika itu terjadi akan berakibat yang sangat fatal bagi kesehatan tubuh.
Larutan buffer karbonat-biokarbonat (H2CO3 / HCO3-) yang bertugas menjada pH dalam tetap 7,4 dengan menjaga perbandingan antara konsentrasi {H2CO3} : {HCO3-} = 1:20. Disamping itu juga terdapat larutan buffer dihidrogenfost- monohidrogenfosfat [H2PO4- / HPO42-) dalam cairan intra sel dan dalam air ludah yang memiliki fungsi menjaga pH mulut disekitar 6,8, dengan cara menetralisir asam hasil fermentasi sisa makanan yang bisa merusak gigi.
Selain itu, larutan penyangga juga dimanfaatkan pada obat-obatan, hal ini bertujuan untuk mentransfer kelebihan basa ataupun asam dari kandungan obat, sehingga perubahan pH pada perut dapat dinetralisir. Jika obat tidak mengandung larutan buffer, tentu saja obat justru akan menimbulkan masalah lain bagi tubuh.
Sifat Larutan Penyangga

Sifat-sifat yang dimiliki oleh larutan penyangga atau buffer yaitu:
- pH pada larutan tidak berubah (tetap) jika larutan ditambah basa ataupun asam.
- pH larutan tidak berubah (tetap) jika larutan diencerkan.
Hubungan pH dengan larutan penyangga atau larutan buffer yakni seperti berikut ini:
- Larutan penyangga dari campuran asam lemah dan garamnya
![]()
![]()
- Larutan penyangga dari campuran basa lemah dan garamnya
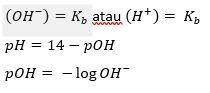
Larutan penyangga atau larutan buffer adalah suatu senyawa yang terdiri atas larutan buffer asam dan larutan buffer basa, dimana berfungsi untuk mempertahan pH agar tidak berubah (konstan) meskipun telah ditambahkan basa, asam ataupun air. Komponen yang terdapat di dalam larutan penyangaa berfungsi untuk menahan naiknya pH (larutan penyangga asam) ataupun turunnya pH (larutan penyangga basa).

