Asam dan basa merupakan dua senyawa kimia yang paling banyak dijumpai pada kehidupan sehari-hari. Pasti kamu pernah memakan jeruk dalam bentuk buah ataupun jus bukan? Bagaimana dengan cuka, obat atau daun pepaya?
Jeruk dan cuka memiliki rasa masam, sementara obat dan daun pepaya berasa pahit bukan? Pada zaman dahulu, salah satu cara untuk membedakan larutan asam basa adalah dengan mengecap atau mencicipinya. Akan tetapi setelah teknologi semakin maju, cara tersebut sudah ditinggalkan. Selain tidak efektif, senyawa asam atau basa dalam kadar tinggi juga bersifat berbahaya.
Pengertian Larutan Asam Basa

Larutan asam basa adalah larutan dengan kadar kebasaan atau keasaman suatu zat tergantung pada jumlah ion asam (H+), serta ion basa (OH-) dalam zat dan derajat ionisasi pada zat tersebut. Tingkat kebasaan dan keasaman dinyatakan dalam pH.
Teori Asam Basa

Asam serta basa atau alkali sudah dikenal dari dulu dan sering kita temukan dalam kehidupan sehari-hari. Misalnya asam sitrat pada jeruk, asam tartrat pada buah anggur, asam sulfat dalam air aki, asam asetat pada cuka dan masih banyak lagi lainnya. Sedangkan zat basa bisa kita dapatkan pada air kapur, obat maag, sabun serta zat lainnya.
1. Teori Asam Basa Lewis
G.N Lewis adalah seorang ahli kimia yang menemukan teori asam basa. Dalam teori asam basa Lewis, basa merupakan zat yang mempunyai satu bahkan lebih pasangan elektron bebas yang bisa dilepaskan untuk zat lain sehingga membentuk suatu ikatan kovalen koordinasi. Sementara asam merupakan zat yang bisa menerima pasangan elektron bebas yang telah dilepaskan tersebut.
2. Teori Asam Basa Stevante Arrhenius
Stevante Arrhenius berpendapat bahwa asam merupakan suatu zat, yang mana bila zat tersebut dilarutkan ke dalam air akan mengasilkan ion H+ dan akan menjadi ion positif satu-satunya di dalam larutan. Sementara basa merupakan zat dimana bila dilarutkan ke dalam air akan terurai dan menghasilkan ion OH- yang merupakan ion negatif satu-satunya dalam larutan tersebut. Berikut ini adalah contoh asam dan basa menurut teori asam basa Arrhenius yaitu:

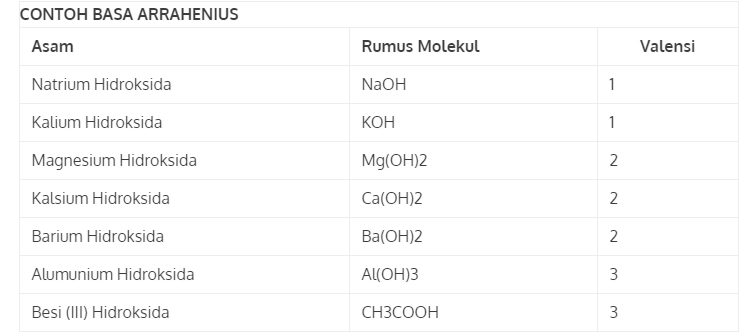
3. Teori Asam Basa Bronstead Lowry
T.N Lowry beserta J.N Bronstead mengemukakan teori yang lain mengenai asam dan basa. Menurut teori Bronstead Lowry, asam merupakan zat yang mentransfer proton atau pendonor proton. Sementara basa merupalan zat yang menerima proton atau akseptor proton. Dari definisi tersebut bisa ditarik kesimpulan bahwa asam akan membentuk suatu konjugat sesudah melepaskan proton, begitu sebaliknya dengan basa yang membentuk konjugat sesudah menerima proton.
Sifat-Sifat Asam dan Basa
Sebagai suatu senyawa, larutan asam basa tentu saja memiliki sifat atau karakteristik tersendiri. Adapun sifat yang dimiliki oleh asam ataupun basa yaitu:
1. Sifat Larutan Asam
Di dunia kimia, asam adalah senyawa kimia yang mana jika dilarutkan ke dalam air selanjutnya akan menghasilkan larutan dengan pH < 7. Asam juga bisa diartikan dengan zat pemberi proton berupa ion H+ kepada zat lainnya yakni basa, namun juga dapat menerima dari basa berupa pasangan elektron bebas.
Adapun sifat yang dimiliki oleh larutan asam yaitu:
- Rasa yang masam
- Bisa mengubah lakmus biru kemudian menjadi lakmus merah
- Asam kuat bisa menghantarkan arus listrik
- Bila dilarutkan ke dalam air akan melepaskan ion H+ (hidrogen)
- Bisa menetralkan basa
- Bersifat korosif (menyebabkan karat) terhadap logam
2. Sifat Larutan Basa
Basa merupakan senyawa kimia yang mampu menyerap ion hidronium saat dilarutkan ke dalam air. Basa mempunyai pH lebih dari 7. Apabila dilarutkan ke dalam air maka akan terionisasi menjadi OH- serta kadang mengandung ion positif logam (tidak selalu). Karena itulah basa bisa menghantarkan arus listrik.
Adapun beberapa sifat yang dimiliki oleh basa yaitu:
- Bisa mengubah warna lakmus merah menjadi biru
- Akan terasa licin ketika mengenai kulit
- Jika dilarutkan ke dalam air akan melepaskan ion OH-
- Bisa menetralkan asam
- Basa kuat dapat menghantarkan arus listrik.
Jenis-Jenis Larutan Asam Basa
Berikut adalah jenis-jneis larutan asam basa yang bisa kamu ketahui:
1. Jenis Larutan Asam
Larutan asam dapat dibedakan ke dalam dua jenis, yaitu larutan asam kuat dan juga lemah. Pernahkah kamu melihat besi yang berkarat? Hal tersebutlah yang membuktikan bahwa asam memiliki sifat korosif terhadap logam. Apabila suatu asam dilarutkan sampai seluruh ion H+ dapat terlepaskan, maka larutan tersebut disebut dengan asam kuat. Sementara bila ion H+ yang terlepas hanya sebagian kecil saja, maka larutan tersebut merupakan asam lemah.
Asam lemah tidak bisa menghantarkan arus listrik, sementara asam kuat mampu menghantarkan arus listrik. Contoh asam kuat yaitu seperti asam nitrat [HNO3], asam lambung/asam klorida [HCl], asam sulfit [H2SO3], asam sulfat [H2SO4], asam nitrit [HNO2] dan asam bromida [HBr].
Sedangkan contoh asam lemah yaitu asam asetat [CH3COOH], asam sianida [HCN], asam karbonat [H2CO3], asam sulfida [H2S], asam fosfat [H3PO4] dan lain sebagainya.
2. Jenis Larutan Basa
Apabila basa dilarutkan ke dalam air serta hampir seluruh ionnya yakni OH- dilepaskan, maka basa tersebut merupakan basa kuat. Sedangkan apabila hanya sebagian kecilnya saja dari ion OH- yang dilepaskan, maka larutan tersebut adalah basa lemah.
Contoh dari basa kuat adalah kalsium hidroksida [KOH], natrium hidroksida [NaOH] dan barium hidroksida [Ba(OH)2]. Sedangkan yang termasuk ke dalam basa lemah antara lain aluminium hidroksida [Al(OH)3] dan ammonium hidroksida [NH4(OH).
Indikator Asam Basa
Jika zaman dahulu untuk mengukur kadar asam basa dilakukan dengan cara mengecapnya, kini terdapat indikator yang mampu mengecek kadar asam basa dengan lebih mudah, praktis dan hasil yang relevan tentunya. Indikator asam basa antara lain:
1. Indikator Lakmus
Indikator lakmus terdiri dari lakmus merah dan lakmus biru. Lakmus merah bisa merubah warna jika terkena basa dan akan konstan jika terkena asam atau suatu zat netral. Sementara lakmus biru akan menjadi merah jika terkena asam dan tidak akan bereaksi jika terkena zat netral ataupun basa.
2. Indikator Universal
Kertas lakmus hanya dapat digunakan untuk membedakan suatu zat apakah basa atau asam, sementara indikator universal dapat menunjukkan tingkat kebasaan maupun keasamaan pada suatu zat. Berikut ini kertas standard pada indikator universal.
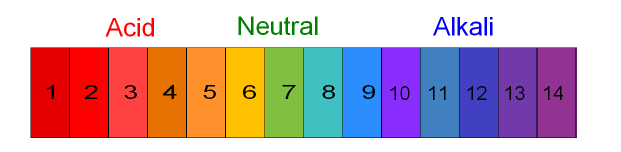
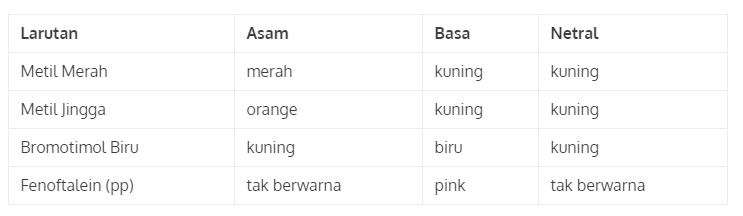
3. Indikator Larutan
Sama halnya dengan indikator kertas lakmus, indikator larutan juga berfungsi untuk membedakan kandungan suatu zat, apakah basa atau asam dengan menunjukkan perubahan warna. Untuk lebih jelasnya perhatikan tabel di berikut ini:
4. Indikator Alami
Selain indikator yang telah disebutkan di atas, ada juga indikator alami yang dapat kamu temui pada kehidupan sehari-hari, yakni berupa tanaman tertentu. Antara lain:
| Larutan | Asam | Basa | Netral |
| Bunga kana | Jingga | Hijau Muda | Kuning |
| Bunga Sepatu | Merah | Hijau | Merah |
| Bunga Terompet | Merah | Hijau | Ungu |
Larutan asam basa merupakan larutan senyawa yang paling sering dijumpai dalam kehidupan sehari-hari. Kekuatan dari suatu larutan asam basa ditentukan oleh banyaknya derajat ionisasi serta ion H+ serta OH- yang berhasil dilepaskan. Larutan asam basa, masing-masing terbagi menjadi asam kuat dan asam lemah, serta basa kuat dan basa lemah.

