Hidrolisis garam – Suatu asam yang bereaksi dengan suatu basa akan menghasilkan senyawa ionik berupa garam. Sementara larutan memiliki beberapa kemungkinan sifat yaitu asam, basa ataupun netral. Hal ini disebabkan adanya hidrolisis pada garam, yakni reaksi dari kation atau anion atau keduanya terhadap air yang menghasilkan ion OH- (aq) ataupun H+ (aq). Berikut penjelasan lebih lengkapnya:
Pengertian Hidrolisis Garam
Setelah membaca sedikit penjelasan di atas, lalu apa yang disebut dengan hidrolisis?
Hidrolisis merupakan kata yang berasal dari hidro (air) dan lisis (pengurainya). Sehingga hidrolisis dapat didefinisikan sebagai reaksi penguraian yang berlangsung di air. Jadi bisa dikatakan bahwa:
Pengertian hidrolisis garam adalah reaksi penguraian garam di dalam air yang menghasilkan ion positif serta ion negatif.
Tidak semua jenis garam dapat mengalami hidrolisis, hanya garam yang memiliki kandungan basa lemah dan asam lemah saja yang dapat mengalami hidrolisis, sementara garam dengan basa kuat dan asam kuat tidak akan mengalami reaksi tersebut.
Reaksi hidrolisis merupakan reaki kebalikan atau berlawanan dengan reaksi penetralan atau penggaraman. Reaksi penetralan atau penggaraman adalah suatu reaksi yang terjadi antara basa dam asam yang menghasilkan garam. Garam yang dihasilkan akan bersifat sesuai dengan kekuatan asam basa yang dimiliki oleh pembentuk garam tersebut.
Macam-Macam Garam Berdasarkan Zat Penyusunnya
Secara umum, larutan garam hasil dari reaksi asam kuat terhadap basa lemah maka akan bersifat asam, sementara larutan garam hasil dari reaksi asam kuat terhadap basa kuat akan bersifat netral, dan larutan garam hasil dai reaksi asam lemah terhadap basa kuat makan akan bersifat basa.
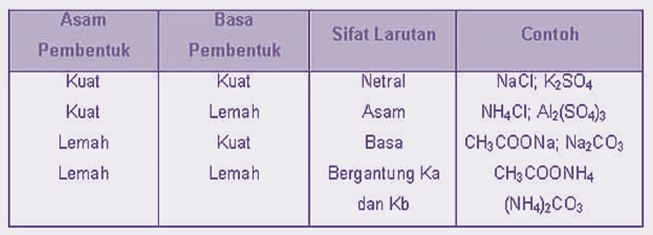
1. Garam yang Tersusun dari Asam Lemah dan Basa Lemah
Garam yang terbentuk dari asam lemah serta basa lemah akan mengalami reaksi hidrolisis total di dalam air. Hal tersebut disebabkan zat penyusun (anion asam lemah & kation basa lemah) mengalami hidrolisis dan menghasilkan ion H+ serta ion OH–.
Dengan begitu, harga pH larutan tergantung dengan harga Ka dan juga Kb. Misalnya (NH4)2S. NH4CN, CH3COONH4 dan lain sebagainya.
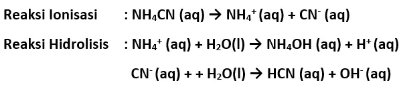
Rumus :
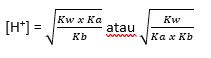
Dengan:
- Kw: Konstanta air
- Ka: Konstanta asam
- Kb: Konstanta basa
- Kh: Konstanta hidrolisis
Harga pH garam yang terbentuk dari asam lemah serta basa lemah sesuai dengan harga Ka dan juga Kb, yakni:
- Jika Ka = Kb, maka larutan akan bersifat netral dengan pH = 7.
- Jika Ka > Kb, maka larutan akan bersifat asam dengan pH < 7.
- Jika Ka < Kb, maka larutan akan bersifat basa dengan pH > 7.
2. Garam yang Tersusun dari Asam Kuat dan Basa Lemah
Garam NH4Cl merupakan garam yang dapat tersusun dari asam kuat (HCl) serta basa lemah (NH3) yang akan mengalami reaksi hidrolisis kation dari basa lemah yang menyebabkan larutan bersifat asam dengan pH < 7. Anion Cl– tidak dapat terhidrolisis karena termasuk basa konjugasi sangat lemah.
Sementara kation NH4+ bisa terhidrolisis dikarenakan termasuk asam konjugasi lemah dari basa lemah tersebut, sehingga bisa mentransfer proton kepada H2O serta membentuk ion H3O+ (hidronium).
Kation yang dapat terhidrolisis antara lain seperti:
- Kation logam yang memiliki densitas muatan tinggi, misalnya Cr3+, Fe3+, Cu2+, Al3+ dan Ni2+.
- Kation asam konjugasi yang berasal dari basa lemah, misalnya CH3NH3+, NH4+, C5H5NH+. Dan C6H5NH3+.
Apabila kation terhidrolisis dimisalkan dengan BH+, sehingga reaksi hidrolisis bisa ditulis seperi di bawah ini:
BH+(aq) + H2O(I) ⇌ B(aq) + H3O+(aq)
Reaksi tersebut juga dapat dituangkan dalam bentuk sederhana, yaitu seperti di bawah ini:
BH+(aq) ⇌ B(aq) + H+(aq)
Misalnya NH4Cl, (NH4)2SO4, CuSO4, AgNO3 dan lain sebagainya.
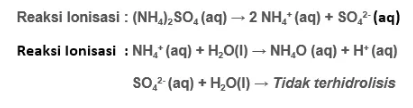
Rumus:
![]()
Dengan:
- Kw: Konstanta air
- Ka: Konstanta asam
- Kb: Konstanta basa
- Kh: Konstanta hidrolisis
- [G]: konsentrasi garam
- h: derajat hidrolisis
Sementara untuk mencari besar atau kecilnya derajat hidrolisis garam dari asam kuat serta basa lemah, maka dapet menggunakan rumus di bawah ini:
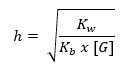
3. Garam yang Tersusun dari Asam Lemah dan Basa Kuat
Garam seperti KCN merupakan garam yang dapat tersusun dari asam lemah (HCN) serta basa kuat (KOH) yang akan mengalami reaksi hidrolisis anion dari asam lemah, dengan demikian menyebabkan larutan bersifat basa.
Kation K+ tidak mengalami hidrolisis serta kation K+ yang telah terhidrasi mempunyai densitas muatan rendah dan menyebabkan tidak berpengaruh terhadap keasaman larutan. Sementara anion CN- bisa terhidrolisis karena termasuk basa konjugasi lemah dari asam lemah tersebut, sehingga bisa menarik proton H2O serta membentuk ion OH- hidroksida.
Anion basa konjugasi yang berasal dari asam lemah yang bisa terhidrolisis dan menghasilkan ion OH-, seperti:
CN–, CO32-, NO2–, HS–, F–, S2-, PO43-, C2O42-, CH3COO–, CIO–, HCOO– dan C6H5COO–.
Apabila anion yang mengalami hidrolisis dimisalkan dengan A–, sehingga reaksi hidrolisis dapat dituangkan seperti di bawah ini:
A–(aq) + H2O(I) ⇌ HA(aq) + OH−(aq)
Dikarenakan hanya sebagian ion (anion asam lemah) yang mengalami reaksi hidrolisis dan menghasilkan ion OH- maka nilai pH menjadi pH > 7 kemudian larutan bersifat basa. Misalnya KCN, CH3COONa, CaS, CH3COOK dan lain sebagainya.
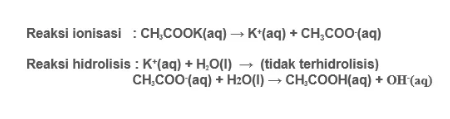
Rumus:
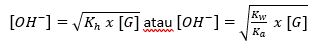
4. Garam yang Tersusun dari Asam Kuat dan Basa Kuat
Garam yang tersusun dari asam kuat serta basa kuat tidak bisa mengalami hidrolisis, hal ini disebabkan kedua komponen penyusunnya (ion anion dan kation) tidak terhidrolisis maka pH = 7 dan larutan memiliki sifat netral. Misalny Na2SO4. NaCl, KCl, NaNO3, Ba(NO3) dan K2SO4 dan lain sebagainya.
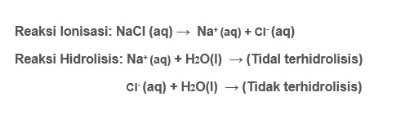
Jenis-Jenis Hidrolisis Garam
Jenis-jenis hidrolisis garam dapat dibedakan menjadi 2 macam, yakni hidrolisis sebagian atau parsial dan hidrolisis total. Adapun penjelasannya yaitu:
1. Hidrolisis Sebagian atau Parsial
Hidrolisis parsial atau sebagian adalah reaksi garam terhadap air, dimana ion yang bereaksi yakni anion ataupun kationnya saja. Garam yang dapat mengalami hidrolisis sebagian yaitu:
- Garam yang tersusun dari asam lemah serta basa lemah.
- Garam yang tersusun daru asam kuat serta basa lemah.
2. Hidrolisis Total
Hidrolisis garam total merupakan reaksi garam terhadap air, dimana semua ion penyusun garam dapat terhidrolisis oleh air, baik anionnya maupun kationnya. Hidrolisis total hanya dapat dialami oleh garam yang tersusun dari asam lemah dan juga basa lemah.
Kesimpulan :
Hidrolisis Garam merupakan reaksi penguraian garam terhadap air, dimana dapat dialami oleh ion penyusunnya, baik kation atau anion atau bahkan keduanya. Hanya garam yang mengandung asam lemah serta basa lama saja yang dapat terhidrolisasi. Sementara garam dengan asam kuat dan basa kuat tidak dapat mengalami hidrolisasi.

