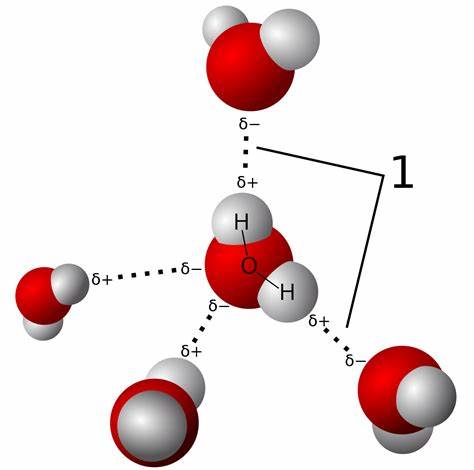
Apa itu ikatan hidrogen? Kok ikatan ya, kaya tali aja hehe. Ikatan hidrogen adalah gaya tarik molekul-molekul antara atom sangat elektronegatif dengan atom hidrogen terikat atau yang biasa dilambangkan dalam N, F atau O serta pasangan elektron bebas yang berasal dari atom sangat eletronegatif lain.
Ikatan hidrogen terjadi seperti ikatan O-H, N-H serta F-H yang bersifat sangat polar, yang mana muatan parsial positif di H dan muatan parsial negatif di atom elektronegatif (N, F atau O).
Contoh ikatan hidrogen yang terdapat pada molekul-molekul H2O serta molekul NH3, seperti yang terlihat pada ilustrasi di bawah ini:
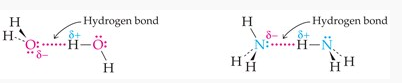
Pengertian Ikatan Hidrogen
Sebenarnya, ikatan hidrogen adalah gaya dipol-dipol antar molekul polar. Akan tetapi, gaya interaksi yang dimiliki oleh ikatan hidrogen relatif lebih kuat dari gaya dipol-dipol pada umumnya, hal ini membuat ikatan hidrogen digolongkan secara khusus.
Mengapa ikatan hidrogen lebih kuat dibandiingkan gaya dipol-dipol? Hal tersebut dikarenakan atom hidrogen tidak mempunyai shielding elektron, ini yang berfungsi melindungi inti atom. Selain itu, ukurannya relatif kecil sehingga lebih mudah didekati oleh para molekul lain, serta muatan parsial negatif dari pasangan elektron dan jarak antar hindrogen bebas sehingga sangat dekat.
Keadaan tersebut lah yang membuat gaya interaksi dipol-dipol antar hidrogen dengan pasangan elektron bebas dalam atom elektronegatif jadai lebih besar, dibandingkan dengan energi interaksi dipol-dipol pada umumnya.
Secara umum, ikatan hidrogen dinotasikan dengan X-H…Y-, dengan X juga Y melambangkan atom sangat elektronegatif (F, N atau O) dan (…) tiga titik menggambarkan adanya ikatan hidrogen.
Ikatan Hidrogen dan Sifat Fisis
Gaya interaksi antar molekul-molekul sangat mempengaruhi titik didih, dan titik lebur yang merupakan sifat fisis. Terbentuknya ikatan hidrogen karena adanya gaya interaksi antar molekul yang terkuat memberikan pengaruh secara segnifikan bagi titik didih pada beberapa senyawa hidrida biner dari unsur golongan IVA sampai VIIA.
Agar kamu bisa lebih memahaminya, di bawah ini adalah grafik titik didih unsur golongan IVA sampai VIIA dan juga senyawa-senyawa biner hidrogen.
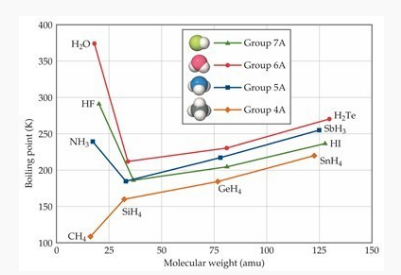
Titik didih senyawa hidrida unsur dari golongan IVA (SnH4, SiH4, CH4, GeH4, semuanya nonpolar) meningkat bermula dari atas kemudian ke bawah golongan ( dari C ke Sn). Keadaan ini bisa dipahami sebagai akibat adanya polarisabilitas serta gaya dispersi London umumnya, terusnya meningkat sebanding dengan bertambahnya massa molekul.
Senyawa hidrida dari golongan VIIA, VIA dan VA pada umumnya juga mengikuti pola meningkatnya titik didih yang sama, akan tetapi khusus senyawa HF, NH3 dan H2O titik didihnya lebih tinggi dari perkiraan sebelumnya.
Faktanya, ketiga senyawa tersebut memiliki sifat yang membedakannya dari senyawa lain dengan polaritas serta massa molekul yang hampir sama. Contohnya, H2O (air) mempunyai titik leleh tinggi, kalor penguapan tinggi dan kalor jenis yang tinggi pula.
Sifat-sfat inilah yang membuktikan adanya ikatan hidrogen dari gaya molekul-molekul tidak lazim dan sangat kuat dalam ketiga senyawa di atas.
Ikatan Hidrogen pada Air
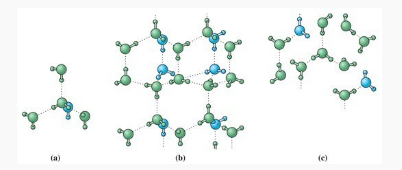
Satu molekul air memiliki ikatan hidrogen dengan empat molekul air lainnya di sekitar dalam susunan tetrahedral layaknya yang terlihat pada gambar a di atas. Sedangkan pada es, para molekul air berikatan hidrogen dalam susuan yang terbuka meskipun lebih kaku. Susunan yang berongga dan terbuka pada es dapat kamu lihat pada gambar b di atas ya. Berakibat es mempunyai massa jenis (densitas) yang lebih kecil.
Ketika es melebur, sebagian dari hidrogen putus. Hal tersebut mengakibatkan molekul air bisa tersusun menjadi lebih rapat hingga massa jeninta meningkat, seperti yang kamu lihat pada gambar c. Sehingga dapat dikatakan bahwa jumlah molekul H2O per satuan volum lebih banyak dalam wujud cair jika dibandingkan dengan H2O dalam wujud padat.
Ketika air es dipanaskan pada titik lebur, ikatan hidrogen akan terus memutus hingga molekul-molekul air semakin tersusun rapat dan massa jenis air juga semakin meningkat. Air dalam bentuk cair dengan suhu 3,98°C akan mencapai densitas atau massa jenis maksimum.jika air bersuhu di atas itu, maka air akan bersifat normall seperti zat pada umunya, yang mana massa jenis air akan menurun seiring dengan kenaikan suhu air.
Sifat anomali air tesebur sangat berperan dalam beberapa fenomena di bumi, contohnya gunung es yang mengapung di atas air, meledaknya pipa air yang terjadi pada musim salju. Terjadinya ledakan pipa merupakan akibat dari air yang mendingin secara mendadak, dimana air yang berubah menjadi es mengalami pemuaian.
Sedangkan pada peristiwa es yang mengapung di atas perairan yang membeku pada musim salju, mengapungnya es di atas perairan akan menghambat pembekuan air yang lebih lanjut. Dengan begitu, makhluk hidup di dalam perairan akan tetap bisa bertahan hidup.
Bisa dibayangkan, jika sifat anomali pada air tidak ada, maka perairan akan membeku hingga dasar dan permukaan. Keadaan tersebut tentu saja akan sangat mengancam keberlangsungan makhluk hidup pada musim salju.
Ikatan Hidrogen pada Makhluk Hidup
Reaksi kimia pada tubuh makhluk hidup seperti DNA dan protein terbentuk dari senyawa dengan struktur yang sangat kompleks, dimana dalam reaksi tersebut adanya ikatan harus dapat dengan mudah diputus maupun dbentuk kembali. Nah, ikatan hidrogen adalah ikatan dimana energinya begitu pas dan memungkinan dalam mewujudkan hal tersebut.
Hal ini dikarenakan ikatan hidrogen memiliki energi ikatan yang terbesar dibandingkan dengan gaya-gaya interaksi molekul pada umumnya. Serta energinya relatif kecil jika dibandingkan dengan ikatan kimia intramolekul, yaitu ikatan ionik juga ikatan kovalen.
Ikatan hidrogen sangat berpengaruh secara segnifikan pada bentuk suatu molekul protein, hal ini berarti jika ada ikatan yang terputus maka fungsi dari molekul protein dapat menghilang. Selain itu, ikatan hidrogen juga sangat penting dalam membentuk ikatan kedua untai molekul DNA hingga membentuk heliks ganda.
Ikatan hidrogen yang tidak terlalu kuat dapat mempertahankan suatu struktur rantai ganda DNA, akan tetapi juga bisa diputuskan dengan mudah pada proses replikasi DNA pada pembelahan sel.
Contoh Soal Ikatan Hidrogen:
Tentukan senyawa manakah yang molekulnya bisa membentuk ikatan hidrogen.
- CH3OH
- CHCI3
- CH3OCH3
- CH3F
- CH3NH2
Jawab:
Ikatan nitrogen hanya bisa terbentuk antar atom elektronegatif F, N atau O dan memiliki pasangan elektron bebas dengan atom H yang memiliki ikatan dengan atom elektronegatif F, N atau O.
Dengan begitu, senyawa yang molekulnya bisa terikat hidrogen harus memiliki atom F, N atau O yang berikatan secara langusng dengan H ( ikatan O-H, N-H ataupun F-H).
Sehingga:
- CH3OH dapat, karena terdapat ikatan O-H yaitu atom O yang berikatan dengan atom H.
- CHCI3 tidak dapat, karena tidak mempunyai atom N, F ataypun O.
- CH3OCH3 tidak dapat, karena hanya ada ikatan C-O dari atom O dan atom C, bukan ikatan O-H.
- CH3F tidak dapat, karena hanya ada ikatan C-F, bukan F-H
- CH3NH2 dapat, karea terdapat atom N serta atom H yang berikatan dan membentuk ikatan N-H.
Nah, itulah pembahasan kita mengenai ikatan hidrogen mulai dari pengertian, sifat serta contoh soalnya. Semoga bermanfaat dan membantu proses belajar kamu ya!