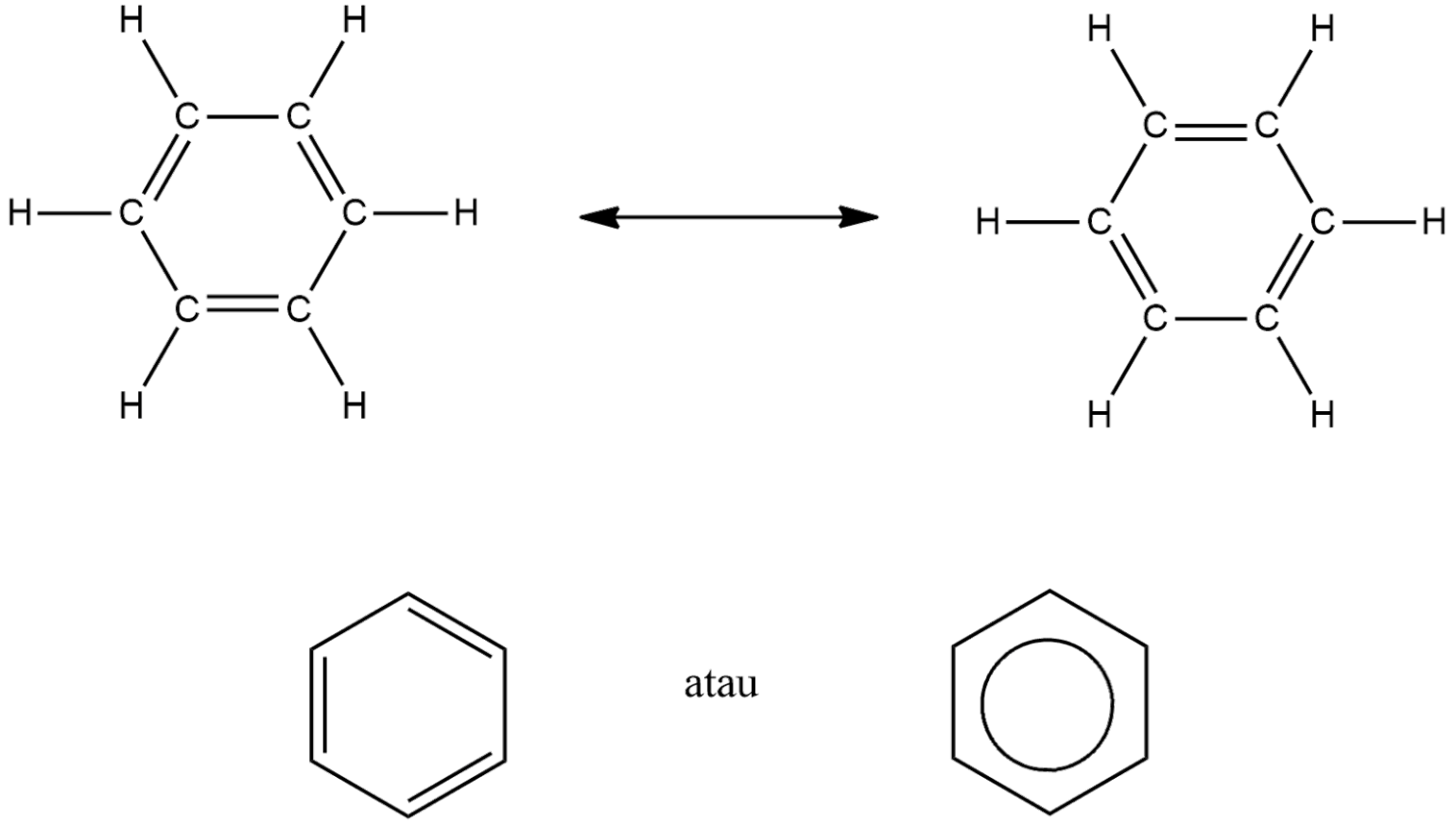
Tahukah kamu apa itu senyawa benzena? Senyawa benzene merupakan salah satu senyawa organik serta mempunyai rumus molekul C6H6 dan tersusun atas enam atom karbon yang saling berikatan satu dengan lainnya membentuk seperti cincin. Dimana setiap atom karbon mengikat 1 atom hydrogen.
Benzena adalah satu bahan kimia yang umum digunakan dalam dunia industry kimia, terutama dimanfaatkan sebagai prekursor dalam sintesis untuk berbahai bahan kimia lain. Benzena termasuk dalam senyawa hidrokarbon aromatic. Disebut aromatic, karena Ketika pertama kali ditemukan, senyawa golongan tersebut mempunyai aroma yang begitu khas.
Meski begitu, kini istilah aromatik dihubungkan dengan sifat-sifat khas dan struktur tertentu selain dari aroma khasnya. Hal tersebut dikarenakan telah diketahui ada beberapa senyawa aromatic yang tidak berbau.
Struktur Benzena
Seperti yang telah disebutkan di atas, benzena mempunyai rumus kimia C6H6. Perbandingan antara jumlah atom C dan H mengidentifikasi bahwa senyawa benzena sangat tidak jenuh. Mulanya, para ahli berpendapat bahwa benzena mempunyai struktur alifatik karena adanya ikatan rangkap dua maupun tiga.
Akan tetapi, fakta menunjukkan bahwa benzena tidak memiliki sifat ketidak jenuhan dari struktur tersebut. Hasil eksperimen membuktikan bahwa benzena memiliki sifat-sifat seperti di bawah ini:
- Monosubstitusi atom holagen X pada benzena menghasilkan hanya satu jenis senyawa saja, yakni C6H5. Hal tersebut menunjukkan tidak adanya keisomeran geometri layaknya pada alkena.
- Benzena ternyata tidak reaktif atau sangat stabil.
Benzena tidak mau bereaksi terhadap Br2, kecuali dengan adanya bantuan katalis. Hal tersebut tidak seperti alkuna ataupun alkena yang mudah diadisi bromin.
Di tahun 1865, August Kekule berpendapat bahwa struktur benzena seperti suatu cincin yang terdiri atas 6 atom C serta dengan ikatan tunggal juga ikatan rangkap dua yang tersusun secara berselang-seling. Meski begitu, struktur tersebut belum bisa menjelaskan sifat-sifat yang dimiliki benzena seperti:
- Benzena cenderung mengalami substitusi walaupun mempunyai ikatan rangkap dua, hal tersebut tidak seperti alkena yang mengalami reaksi adisi.
- Berdasarkan dari hasil pengukuran dengan difraksi sinar X, benzena hanya mempunyai satu panjang ikatan dengan atom C yakni 0,139 nm, yang mengidentifikasi semua ikatan di dalam benzena setara dan sama.
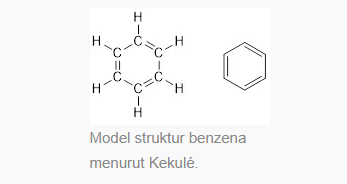
Berdasarkan fakta tersebut, pada tahun 1931 Pauling lalu merumuskan struktur senyawa benzena sebagai struktur hibrida resonansi, yakni struktur yang berada antara dua struktur Kekule. Struktur tersebut membentuk sistem elektron yang dapat menstabilkan struktur.
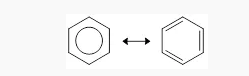
Di atas merupakan gambar struktur dari senyawa benzena menurut Linus Pauling. Tanda atau symbol ↔ menunjukkan bukan setimbang namun beresonansi.
Struktur hibrida resonansi dari benzena dengan lingkaran dalam cincin yang menunjukkan adanya delokalisasi elektron.
Sifat – Sifat Benzena
Benzene merupakan golongan senyawa beracun dan memiliki sifat karsinogenik yakni bisa menyebabkan kanker. Benzena berbentuk cair pada suhu ruang, mudah menguap dan tidak berwarna. Titik didihnya 80°C dan titik lelehnya 6°C. Struktur simetris dan planar mengakibatkan susunan kristalnya lebih rapat serta titik leleh yang menjadi lebih tinggi jika dibandingkan heksana yakni -95°C.
Sama seperti senyawa hidrokarbon pada umumnya, benzena bersifat nonpolar. Oleh sebab itu, benzena dapat larut dalam pelarut nonpolar atau kurang polar seperti tetraklorometana dan eter, tapi tidak larut di dalam pelarut polar, contohnya air.
Benzena relatif tidak begitu reaktif, akan tetapi mudah terbakar. Karena adanya sistem delokalisasi elektron yang dapat menstabilkan benzena, membuat benzena cenderung mudah bereaksi substitusi dibandingkan reaksi adisi.
Reaksi subsitusi benzena melibatkan serangan pereaksi yang bermuatan positif parsial maupun utuh yang elektrofil (suka elektron) pada cincin benzena. Sehingga, reaksi yang benzena alami disebut reaksi substitusi elektrofilik.
Reaksi subsitusi yang terjadi pada benzena, antara lain yaitu:
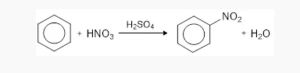
- Nitrasi
Benzena bereaksi terhadap asam nitrat pekat dan katalis asam sulfat pekat yang kemudian membentuk nitrobenzena.
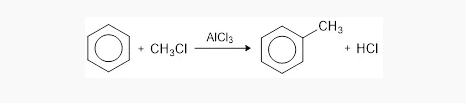
- Alkilasi Friedel – Crafts
Benzena bereaksi terhadap alkil halida serta bantuan katalis aluminium klorida atau AlCl3 membentuk alkilbenzena.
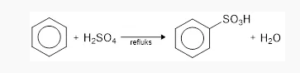
- Sulfonasi
Benzena bereaksi terhadap SO3 dalam asam sulfat pekat, jika dipanaskan akan membentuk asam benzenasulfonat.
- Halogenasi
Benzena bereaksi terhadap halogen seperti Br2 dan Cl2 dengan bantuan dari katalis nesi (III), halida (FeBr3 ataupun FeCl3) yang selanjutnya membentuk senyawa halobenzene.
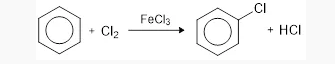
Tata Nama Turunan Benzena
Senyawa turunan benzena bisa ditafsirkan berasal dari benzena yang satu ataupun lebih atom H nya diganti substituent lain dalam bentuk atom, seperti gugus atom -COOH maupun -Br. Berikut ini aturan penamaan senyawa turunan dari benzena yaitu:
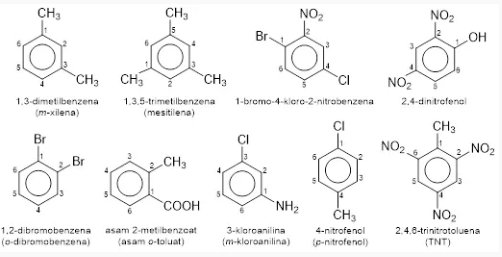
- Jika ada lebih dari satu substituen maka penomoran diberi berlawanan atau searah dengan arah jarum jam supaya substituent mendapat nomor yang serendah mungkin. Substituent-substituen yang sejenis diberi awalan tri-, di-, penta-, tetra- dan heksa-. Adapun prioritas penomoran pada beberapa substituent umum yakni sebagai berikut:
-COOH; -SO3H; -COOR; -CN; -CHO; -CO; -OH; -NH2; -OR; -R; -X (F, Cl, Br, I), -NO2.
Bila terdapat 2 substituen, selain menggunakan penomoran, dapat juga diberi awalan o- yakni orto untuk urutan atom karbon nomor 1 dan 2, m- yakni meta untuk urutan 1 dan 3, ataupun p- yakni para untuk urutan 1 dan juga 4.
Contohnya yaitu:
- Bila satu atom H dalam benzena diganti dengan satu substituent seperti -CH3, -CI, -NH2, -NO2, -CHO, -Oh dan lain sebagainya. Sehingga struktur serta penamaannya yaitu sebagai berikut:
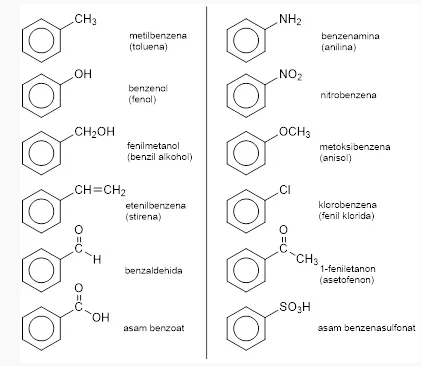
- Bila cincin benzena diartikan sebagai substituent bukan induk, maka gugus benzena akan kehilangan satu atom H C6H5- yang kemudian disebut dengan gugus fenil. Sementara gugus metilbenzena atau toluene akan kehilangan satu atom H C6H5CH2- yang disebut dengan gugus benzil.
Contohnya yaitu:
Manfaat Benzena serta Turunannya
Senyawa benzena serta turunannya memiliki manfaat atau kegunaan yang cukup kompleks bagi kehidupan sehari-hari. Antara lain:
- Benzena
Secara umum benzena digunakan sebagai bahan baku pembentuk senyawa aromatik lain (senyawa turunan) dan banyak juga dimanfaatkan sebagai pelarut.
- Fenol
Fenol dimanfaatkan sebagai disinfektan dan bahan baku pembuatan beberapa obat seperti obat faringitis.
- Toluena
Penggunaan toluena secara umum sama seperti benzena yakni sebagai pelarut, akan tetapi toluene juga bisa dimanfaatkan untuk bahan baku pembuatan trinitrotoluene (TNT), dimana TNT adalah bahan peledak.
- Benzaldehida
Senyawa benzaldehida dimanfatkan untuk bahan baku menghasilkan perisa almond untuk makanan maupun minuman, bahan pengawet makanan dan juga pestisida.
- Anilina
Anilina dimanfaatkan untuk pembuatan zat-zat pewarna diazo.
- Asam Salisilat
Senyawa asam salisilat dimanfaatkan untuk membuat perasa, aspirin, minyak wangi, sampo dan salep anti jamur.
Benzena merupakan senyawa yang banyak dimanfaatkan dalam industry bahan kimia. Benzena juga disebut dengan senyawa hidrokarbon aromatik karena memiliki bau yang khas Ketika pertama kali ditemukan. Benzene termasuk senyawa organik yang tersusun dari 6 atom karbon yang saling berikatan membentuk cincin. Senyawa tersebut beserta turunannya memiliki manfaat yang sangat beragam bagi kehidupan sehari-hari khususnya sektor industri.
Semoga pembahasan di atas membantu ya! Dan tetap semangat belajar meski masih harus SFH 🙂