Rumus Empiris dan Rumus Molekul – Setiap senyawa kimia bisa dinyatakan menggunakan rumus kima yang akan menunjukkan jumlah relatif dari atom-atom unsur yang ada pada senyawa tersebut. Rumus kimia yang digunakan adalah rumus empiris dan rumus molekul.
Rumus Molekul
Rumus molekul lebih sering disebut dengan rumus kimia, Pengertian rumus molekul adalah cara ringkas dan sederhana untuk mengetahui rasio atom-atom yang menyusun senyawa kimia tertentu, dengan menggunakan, nomor, sebaris simbol zat kimia, tanda kurung, tanda plus minus dan kurung siku.
Rumus molekul ini nantinya akan menunjukkan jumlah atom pada suatu senyawa dari masing-masing unsur yang terdapat dalam satu molekul senyawa tersebut. Rumus kimia yang lebih sederhana dari rumus molekul adalah rumus empiris, di mana kamu hanya akan menggunakan angka dan huruf.
Rumus molekul dapat berfungsi membantu mengidentifikasi unsur-unsur penyusun senyawa pada senyawa molekul, dan ditunjukkan dengan simbol kimia serta jumlah atom pada setiap unsur. Jika pada suatu molekul terdapat lebih dari satu atom pada unsur tertentu, maka kuantitas tersebut ditandai dengan penggunaan subskrip di belakang (setelah) simbol kimia. Pada zat non-molekular dan senyawa ionik, subskrip difungsikan untuk menandai perbandingan unsur-unsur dalam rumus empiris.
Jadi untuk mempermudah dalam memahami apa itu rumus molekul, berikut contoh yang bisa memperjelas mengenai rumus ini. Contohnya rumus molekul pada karbon dioksida atau CO2 dan setiap molekul dari CO2 ini terdiri dari 1 atom karbon serta 2 atom oksigen.
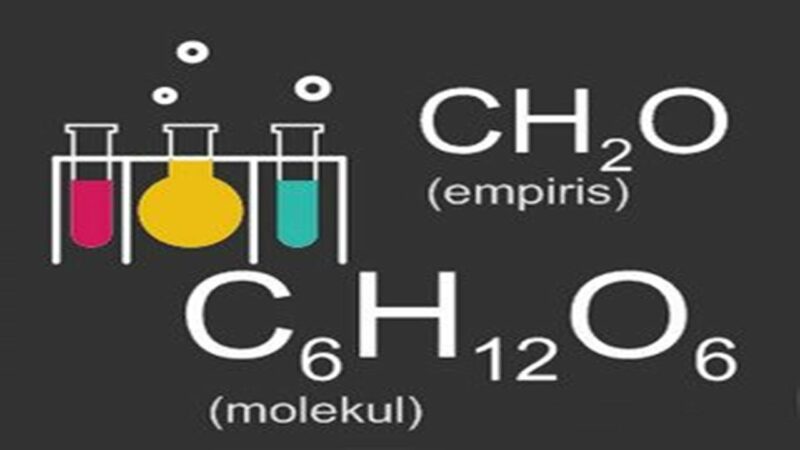
Contoh lainnya, seperti pada asam askorbat. Rumus molekul asam askorbat ialah C6H8O6, setiap molekul vitamin C (asam askorbat) terdiri dari 6 atom karbon, hidrogen 8 atom serta 6 atom oksigen. Nah, itu tadi beberapa contoh dari rumus molekul.
Rumus Empiris
Dalam ilmu kimia, rumus empiris bisa juga disebut dengan komposisi kimia dari suatu senyawa. Pengertian rumus empiris adalah ekspresi yang lebih sederhana dari jumlah relatif setiap unsur kimia atau jumlah atom yang dikandungnya. Dalam formula rumus empiris ini tidak ada gambaran tentang struktur, isomer atau jumlah absolut atom.
Formula dari rumus empiris adalah standar bagi senyawa ion dan makromolekul seperti CaCl2 dan SiO2. Penggunaan istilah empiris sendiri merujuk pada proses elemental, teknik kimia analitis untuk menentukan persentase dari komposisi relatif setiap unsur yang ada di dalam suatu zat kimia. Rumus kimia dan empiris terlihat kontras, karena formula rumus kimia justru mengidentifikasikan mengenai jumlah absolut atom dari unsur yang ditemukan pada molekul di suatu senyawa.
Rumus empiris menunjukkan jumlah atom relatif pada suatu senyawa dari masing-masing unsur di dalam molekul senyawa dengan perbandingan yang lebih sederhana. Sebagai contohnya, rumus empiris (rasio) bilangan bulat dari asam askorbat merupakan C3H4O3 dengan rasio jumlah ketiga atom yakni karbon, hidrogen dan oksigen ialah 3:4:3.
Contoh sederhana adalah rumus empiris karbon dioksida, yakni sama dengan rumus molekulnya yaitu CO2 dengan rasio jumlah atom karbon 1 dan oksigen 2 atau 1:2. Secara umum, rumus kimia atau rumus molekul akan lebih dipilih karena lebih penting dibandingkan dengan rumus empiris, sebab informasi rumus molekul jauh lebih mendetail.
Akan tetapi, dalam beberapa cairan dan padatan, terkadang tidak ditemukan adanya molekul kecil yang bisa dipisahkan, sehingga rumus yang berlaku dan penting pada kasus ini hanyalah rumus empiris nya. Sebagai contohnya adalah padatan garam atau natrium klorida yang mempunyai rumus NaCl.
Dalam kasus ini terdapat gaya tarik-menarik antara atom Na dan Cl yang sangat kuat, sehingga untuk membedakan gaya mana yang bekerja di antara kedua atom NaCl dikatakan cukup mustahil. Hal ini karena semua gaya tarik bekerja pada kedua atom, Na dan Cl juga memiliki tenaga sama besar.
Oleh karena itu, padatan natrium klorida ini dinyatakan dengan rumus empiris menggunakan sebutan formula unit atau unit rumus NaCl dan bukan sebuah molekul NaCl. Terdapat beberapa padatan lain yang juga hanya bisa dirumuskan dengan bentuk unit rumus, seperti zink sulfida (Zn), silikon dioksida (SiO2) dan kalsium fluorida (CaF2).
Rumus Empiris dan Kadar Unsur dalam Senyawa
Kadar unsur pada senyawa biasanya dinyatakan dalam persentase massa unsur terhadap massa senyawa. Kadar unsur tersebut juga bisa dinyatakan dengan massa unsur dalam 1 mol senyawa yang dibagi dengan massa molar pada senyawa tersebut kemudian dikali 100%. Massa unsur pada 1 mol senyawa = jumlah mol unsur dalam 1 mol senyawa kemudian dikalikan dengan massa molar dari unsur.
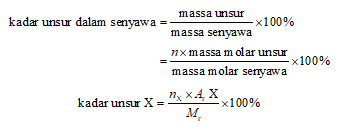
Rumus empiris suatu senyawa bisa diketahui dengan mengkonversi hasil dari kadar unsur penyusun senyawa menjadi rasio mol unsur. Caranya yakni dengan mengasumsikan sampel senyawa 100 gram, sehingga massa dari masing-masing unsur bisa didapatkan dari kadar unsur, kemudian massa unsur tersebut dibagi dengan massa molar unsur, hal ini dilakukan hingga mendapatkan hasil jumlah mol dari masing-masing unsur.
Selanjutnya adalah membandingkan jumlah mol masing-masing unsur tersebut hingga mendapatkan perbandingan dalam bilangan bulat paling sederhana. Perbandingan mol unsur-unsur dalam senyawa inilah yang merupakan hasil dari rumus empiris. Di mana rasio tersebut menunjukkan jumlah relatif dari atom unsur yang terkandung dalam senyawa.
Perbedaan Rumus Molekul dan Rumus Empiris beserta Contohnya
Setelah membahas mengenai rumus molekul dan empiris di atas, maka sekarang saatnya memberikan contoh lebih banyak untuk melihat perbedaan kedua rumus tersebut secara lebih jelas. Sebagai contoh kita ambil dengan n-heksana, dengan rumus molekul berikut CH3CH2CH2CH2CH2CH3, dalam rumus molekul tersebut menyatakan jika senyawa ini mempunyai struktur rantai lurus, dengan 6 atom karbon serta 14 atom hidrogen. Kemudian didapatkan Formula kimia heksananya ialah C6H14, lalu rumus empirisnya yakni C3H7 dengan rasio C:H yaitu 3:7.
Contoh lain dari perbedaan penentuan kedua rumus tersebut, sebagai berikut:
- Glukosa, rumus molekulnya adalah C6H12O6 dan rumus empiris nya adalah CH₂O
- Etena, rumus molekulnya adalah C₂H₄ dan rumus empiris nya adalah CH₂
- Asam Asetat, rumus molekulnya adalah CH₃COOH dan rumus empiris nya adalah CH₂O
- Hidrazin, rumus molekulnya adalah N₂H₄ dan rumus empiris nya adalah NH₂
- Naftalena, rumus molekulnya adalah C10H8 dan rumus empiris nya adalah C5H₄
- Etana, rumus molekulnya adalah C2H6 dan rumus empiris nya adalah CH3
- Butana, rumus molekulnya adalah C4H10 dan rumus empiris nya adalah C2H5
Semua senyawa memiliki rumus empiris, setiap senyawa molekul juga memiliki rumus molekul. Pada umumnya memang cukup banyak senyawa yang rumus molekulnya = rumus empiris nya, seperti air (H2O). Akan tetapi pada senyawa ion, hanya bisa menggunakan rumus empiris saja, seperti garam (NaCl). Dan untuk mendapatkan rumus molekul dari rumus empiris, terlebih dahulu kamu perlu mengetahui tentang massa molar dari senyawa yang akan dibahas.
Maka dari penjelasan di atas bisa disimpulkan bahwa rumus empiris merupakan bentuk sederhana dari rumus molekul. Dan setiap senyawa kimia yang mempunyai rumus molekul pasti mempunyai rumus empiris nya sendiri.