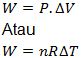Belajar ilmu fisika memanglah sangat banyak dan luas sekali materinya. Kamu harus pasang mata, telinga, dan tingkat kefokusan tinggi untuk lebih memahami secara mendalam materi yang membutuhkan pemahaman secara utuh. Untuk itu, mari fokuskan matamu dari chat pacar kamu, hehe.
Untuk kamu yang gemar belajar fisika tidak akan lengkap jika belum memahami materi tentang termodinamika. Berasal dari kata thermos dan dynamic yang memiliki arti panas dan perubahan atau gerak. Pada materi termodinamika ini intinya kamu akan mempelajari kinerja fisika energi.
Pengertian Termodinamika
Termodinamika merupakan salah satu ilmu fisika yang di dalamnya mempelajari panas maupun temperatur. Selain itu, dalam materi ini kamu juga mempelajari hubungan antara panas dan temperatur dengan dengan gerak dan energinya. Kamu juga akan mengetahui tentang energi panas dapat mengalir, proses alirannya, dan apa yang diakibatkan dari peristiwa tersebut.
Hal di atas sangat berkaitan erat dengan fisika energi, entropi, panas ,dan kespontanan proses. Pada materi ini kamu akan memahami suatu pertukaran energi dalam bentuk sistem pembatas dan lingkungan, serta dalam bentuk kalor dan kerja. Contoh fenomena dalam kehidupan sehari-hari ialah pada saat kamu meniup minuman panas, pembangkit listrik, perkakas elektronik, dan lain sebagainya.
Prinsip Termodinamika
Prinsip dari ilmu ini yakni melibatkan panas, mekanika, dan kalkulus diferensial pada berbagai ilmu pengetahuan lainnya. Hal alami atau fenomena yang terjadi di kehidupan sehari-hari merupakan prinsip dari materi ini. Dalam ilmu ini pun dikenal juga dengan sebuah sistem dan lingkungan, sistem menjadi suatu hal sedang diteliti atau diperhatikan.
Lingkungan merupakan batasan yang memisahan antara sistem dengan bagian luarnya atau semesta. Ada 3 jenis sistem jika diklasifikasikan berdasarkan pertukaran yang terjadi pada sistem dan lingkungan. Berikut adalah 3 jenis sistem tersebut.
1. Sistem Terbuka
Sistem terbuka terjadi pertukaran energi dan benda dengan lingkungannya, yang dimaksud dengan energi ialah panas dan kerja dan yang dimaksud dengan benda ialah materi. Peralatan yang terdapat aliran massanya ke dalam dan keluar merupakan sistem terbuka. Contoh dari peralatan sistem terbuka ialah kompresor, nozel, motor bakar, dan lain sebagainya.
2. Sistem Tertutup
Sistem tertutup terjadi pertukaran energi berupa panas dan kerja, namun tidak terjadi pertukaran benda. Adanya pertukaran panas dan kerja ditentukan dari sifat pembatasnya. Jika pembatasnya adiabatik maka tidak bisa terjadi pertukaran panas. Dan jika pembatasnya rigid maka yang tidak bisa terjadi pertukaran yaitu kerja.
3. Sistem Terisolasi
Sistem terisolasi tidak akan terjadi pertukaran apapun, baik itu benda maupun panas dan kerja. Contoh yang termasuk ke dalam sistem terisolasi ialah suatu wadah yang terisolasi seperti tabung gas.
Hukum Termodinamika
Setiap ilmu fisika terutama ini terdapat empat hukum yang penerapannya berlaku pada bab ini, di antaranya ialah sebagai berikut.
1. Hukum Termodinamika 0
Hukum ini menyatakan bahwa kesetimbangan termal itu berlaku universal, yang artinya semua benda atau zat memiliki kesetimbangan termal yang sama jika disatukan.
2. Hukum Termodinamika 1
Hukum ini merupakan hukum kekekalan energi yang terjadi pada gas. Bunyi dari hukum ini ialah kalor yang diterima gas digunakan untuk mengubah energi dalam gas menjadi usaha. Persamaan yang dimiliki oleh hukum termodinamika 1 ialah sebagai berikut.
Q = ΔU + W
Keterangan:
Q = energi kalor (J)
ΔU = perubahan energi dalam (J)
W = usaha gas (J)
Sedangkan usaha (W) yang terjadi pada gas dapat dihitung menggunakan rumus berikut.
Usaha dan perubahan energi memiliki makna tertentu, berikut ini makna nilai usaha dan perubahan energy sebagai berikut.
a. Jika usaha nilainya positif (+W), maka artinya gas melakukan usaha dan volume akan bertambah atau sering disebut dengan ekspansi.
b. Jika usaha nilainya negatif (-W), maka artinya gas menerima usaha dan volume akan berkurang atau sering disebut dengan kompresi.
c. Jika perubahan energi nilainya positif (+ΔU),maka artinya terbentuk energi dalam dan suhunya akan naik.
d. Jika perubahan energi nilainya (-ΔU),maka artinya energy dalam berubah menjadi usaha dan suhu akan turun.
Perubahan energi dalam dapat dirumuskan sebagai berikut.
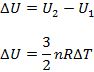
Adapun proses-proses yang terjadi pada gas, di antaranya ialah sebagai berikut.
a. Proses Isobarik
Proses ini memiliki tekanan yang konstan, berikut persamaan yang dimiliki oleh proses isobarik.
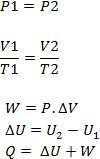
b. Proses Isokhorik
Proses ini memiliki volume yang konstan, sehingga berlaku persamaan seperti berikut.
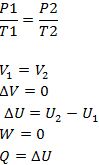
c. Proses Isotermik
Pada proses ini memiliki suhu yang konstan, sehingga berlaku persamaan seperti berikut :
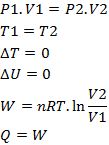
d. Proses Tertutup
Proses ini tidak mengubah nilai kalor pada suatu sistem atau ΔQ = 0
3. Hukum Termodinamika 2
Hukum ini menyatakan bahwa kalor tidak mengalir spontan dari dingin ke panas, kecuali ada usaha dari luar. Tidak ada mesin yang dapat bekerja hanya dengan mengambil energi dari reservoir panas kemudian membuangnya kembali untuk menghasilkan mesin abadi.
Penerapan hukum termodinamika yaitu pada mesin kalor/panas, yang merupakan mesin untuk mengubah kalor dari suatu sumber kalor (reservoir panas) menjadi usaha dan sebagian lainnya dibuang ke lingkungan (reservoir dingin). Secara matematis, persamaan hukum ini dapat ditulis seperti berikut:

Mesin yang menggunakan penerapan dari hukum ini dinamakan dengan mesin carnot. Mesin carnot terbagi menjadi dua yakni mesin panas carnot dan mesin dingin carnot. Mesin panas carnot yaitu mesin panas yang efisiensinya mendekati 100% atau biasanya disebut dengan mesin ideal.
Mesin carnot bekerja membentuk sebuah siklus yang dinamakan dengan siklus carnot. Pada siklus carnot ini terdiri atas 4 proses di antaranya ialah pemuaian dan pemampatan. Pemuaian terbagi menjadi dua yakni pemuaian isothermal dan adibatik. Sedangkan pemampatan juga terbagi menjadi dua yaitu isothermal dan adiabatic.
4. Hukum Termodinamika 3
Hukum ini menyatakan bahwa proses akan berhenti ketika sistem mencapai temperatur non absolut. Saat itu entropi sistem akan mendekati bahkan mencapai nilai minimum. Pada temperatur bernilai nol pada temperatur non absolut bentuk entropi akan berstruktur seperti Kristal.
Contoh Soal Hukum Termodinamika
Gas awalnya mempunyai volume sebesar 20 m3, kemudian gas tersebut dipanaskan dengan secara atau dalam keadaan isobaris sampai volume akhirnya menjadi 50 m3. Tentukan usaha luar yang terjadi pada gas tersebut jika tekanan gasnya ialah 3 atm, dan diketahui bahwa 1 atm = 1,01 x 105 Pa!
Pembahasan
Diketahui:
V1 = 20 m3
V2 = 50 m3
P = 3 atm = 3,03 x 105 Pa
Ditanyakan: W?
Jawab:
Isobaris, maka tekanannya tetap sehingga menggunakan rumus W = P ΔV
W = P(V2 – V1)
W = 3,03 x 105 x (50-20) = 9,09 x 106 Pa