Pernahkah kamu mengalami ban kempes dan mengalami kesulitan sendiri? Apakah kamu tahu apa penyebab ban tersebut dapat kempes? Kamu akan akan menemukan jawaban dari permasalahan teori kinetik gas. Ban yang kempes artinya udara yang ada di dalam ban mengalami penyusutan. Penyusutan tersebut dikarenakan suhu naik sehingga mempengaruhi kenaikan tekanan.
Jika tekanan dalam ban naik maka akan menyebabkan volume udara dalam ban menjadi berkurang, akibatnya ban menjadi kempes. Mungkin kamu akan bertanya-tanya mengapa kenaikan suhu dapat berpengaruh kepada tekanan dan volume. Pada materi teori kinetik gas kali ini kamu akan mengetahui mengenai hal tersebut.
Pengertian Teori Kinetik Gas
Teori kinetik gas membahas tentang sifat-sifat yang dimiliki oleh gas ideal. Gas ideal ialah kumpulan beberapa partikel gas yang tidak saling bersentuhan karena jarak antar partikel sangat jauh dan bergerak secara acak. Sifat-sifat yang dimiliki oleh gas ideal di antaranya ialah sebagai berikut.
- Ukuran partikelnya sangat kecil jika dibandingkan dengan ruangannya.
- Tumbukan antar partikel atau tumbukan dengan ruangan yang lenting sempurna mengakibatkan gas ideal bergerak.
- Gas ideal bergerak menurut garis lurus secara cepat.
- Jumlah partikelnya sangat banyak.
Terdapat persamaan gas ideal yaitu sebagai berikut.
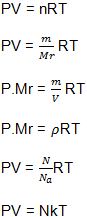
Keterangan:
P = tekanan gas (Pa)
n = jumlah mol (mol)
V = volume gas (m3)
Mr = massa molekul relatif (kg/mol)
m = massa 1 partikel gas (kg)
R = tetapan gas ideal (8,314 × 103 J/kmol.K)
k = konstanta Boltzman (1,38 × 10-23 J/K)
N = jumlah partikel gas
Na = bilangan Avogadro = 6,02 × 1023 partikel/mol
ρ = massa jenis gas (kg/m3)
T = suhu gas (K).
Berdasarkan penjelasan di atas, hubungan antara tetapan, mol, dan jumlah partikel pada persamaan gas ideal. Berikut adalah rumus yang menyatakan hubungan antara berbagai besaran tersebut:
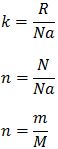
Keterangan:
Na atau L = bilangan Avogadro (6,02 x 1023 partikel)
m = massa benda (gram)
M atau mm = massa molar, Ar atau Mr (gram/mol)
Hukum Standar Teori Kinetik Gas
Tidak hanya pasangan yang harus ideal hehe, gas pun memliki idealnya. Gas ini terdapat suhu, jumlah molekul gas, volume, dan tekanan dan berada pada ruang tertutup. Ada berbagai hukum-hukum standar teori kinetik gas yang dapat menjelaskan hubungan berbagai besaran tersebut. Berikut adalah beberapa hukum standar yang digunakan pada teori kinetik gas yang harus Anda pahami.
1. Hukum Boyle
Hukum Boyle menyatakan bahwa tekanan gas berbanding terbalik dengan volume jika suhu pada suatu gas dijaga secara konstan. Sistem dari hukum boyle dapat dituliskan sebagai berikut.
PV = konstan
P1V1 = P2V2
Keterangan:
P1 = tekanan gas pada keadaan 1 (N/m2)
P2 = tekanan gas pada keadaan 2 (N/m2)
V1 = volume gas pada keadaan 1 (m3)
V2 = volume gas pada keadaan 2 (m3)
2. Hukum Gay-Lussac
Hukum ini menyatakan bahwa tekanan gas sebanding dengan suhu mutlaknya jika volume pada suatu gas dijaga secara konstan. Secara matematis hukum ini dapat dituliskan seperti berikut ini.
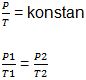
Keterangan:
P1 = tekanan gas pada keadaan 1 (N/m2)
P2 = tekanan gas pada keadaan 2 (N/m2)
T1 = suhu gas pada keadaan 1 (K)
T2 = suhu gas pada keadaan 2 (K)
3. Hukum Charles
Jika tekanan pada suatu gas dijaga secara konstan, hukum ini menyatakan bahwa volume gas sebanding dengan suhu mutlaknya.. Hukum ini biasa disebut dengan istilah isobar. Berikut rumus secara matematis pada Hukum Charles yang harus Anda pahami.
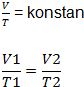
Keterangan:
T1 = suhu gas pada keadaan 1 (K)
T2 = suhu gas pada keadaan 2 (K
V1 = volume gas pada keadaan 1 (m3)
V2 = volume gas pada keadaan 2 (m3)
4. Hukum Boyle-Gay Lussac
Sejumlah partikel mol gas hasil kali antara tekanan dengan volume kemudian dibagi dengan suhu adalah tetap. Hukum ini dapat dirumuskan sebagai berikut:
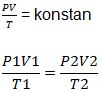
Keterangan:
P1 = tekanan gas pada keadaan 1 (N/m2)
P2 = tekanan gas pada keadaan 2 (N/m2)
V1 = volume gas pada keadaan 1 (m3)
V2 = volume gas pada keadaan 2 (m3)
T1 = suhu gas pada keadaan 1 (K)
T2 = suhu gas pada keadaan 2 (K)
Tekanan Gas Ideal
Adanya tekanan dikarenakan gas berada di dalam ruang tertutup. Penyebab adanya tekanan tersebut adalah tumbukan antar partikel-partikel gas dengan dinding pada ruangan saat gas tersebut berada. Rumus tekanan gas dalam ruang tertutup ialah sebagai berikut.
Keterangan:
N = jumlah partikel gas
m = massa partikel gas (kg)
v = kecepatan rata-rata partikel gas (m/s)
V = volume gas (m3)
Ek = energy kinetik rata-rata partikel gas (joule)
P = tekanan gas (N/m2)
Energi Kinetik Gas
Energi kinetik gas merupakan energi yang dimiliki gas akibat bergerak. Kecepatan yang timbul karena gas bergerak inilah yang dapat memberikan pengaruh terhadap energi kinetik gas. Energi kinetik gas dapat dirumuskan sebagai berikut:.
![]()
Keterangan:
k = konstanta Boltzman (1,38 × 10-23 J/K)
T = suhu gas (K)
N = jumlah partikel;
n = jumlah mol gas (mol)
R = tetapan gas ideal (8,314 J/mol.K)
Ek = energi kinetik rata-rata partikel gas (joule)
Sedangkan untuk kecepatan gas pada ruangan tertutup dapat dihitung dengan rumus berikut.
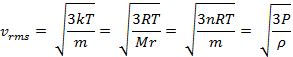
Dilihat dari rumus di atas merupakan massa jenis gas (kg/m3).
Contoh Soal Teori Kinetik Gas
1. Gas pada suhu dan tekanan standar memiliki jumlah mol sebanyak 4 mol. Tentukan volume gas tersebut!
Diketahui:
Suhu dan tekanan standar, maka suhunya 0 ºC dan tekanannya 1 atm.
T = 0 + 273 = 273 kelvin
P = 1 atm = 1,01 × 105 N/m2
N = 4 mol
R = 8,314 J/mol.K
Ditanya: V =…?
Jawab:
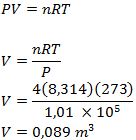
Jadi volume 4 mol gas pada saat suhu dan tekanan standar ialah 0,089 m3.
2. Gas ideal pada ruang tertutup awalnya memiliki tekanan dan volume sebesar P dan V. Jika tekanan gas dinaikkan hingga 5 kali tetapi volumenya tetap, maka hitunglah perbandingan energi kinetik awal dengan energi kinetik akhir pada gas tersebut!
Diketahui:
P1 = P
P2 = 5P
V1 = V2
Ditanya:
Perbandingan energi kinetik awal dengan energi kinetik akhir (Ek1 : Ek2).
Jawab:
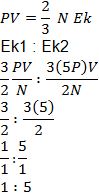
Maka perbandingan energi kinetik awal dengan energi kinetik akhir ialah 1:5.

